4个回答
模块2的前言(2.2 CTD前言)
模块2的前言通常包括以下内容:
- 产品概述:简要介绍产品,包括产品名称、剂型、规格等。
- 研发背景:说明该产品的研发背景,包括国内外上市情况、注册分类及依据。
- 申请事项:阐述本次注册申请的目的和相关支持性研究。
- 加快上市注册程序申请(如适用):如果适用,包括突破性治疗药物程序、附条件批准程序、优先审评审批程序及特别审批程序等,以及其依据。
- 附加申请事项:如减免临床、非处方药或儿童用药等相关信息(如适用)。
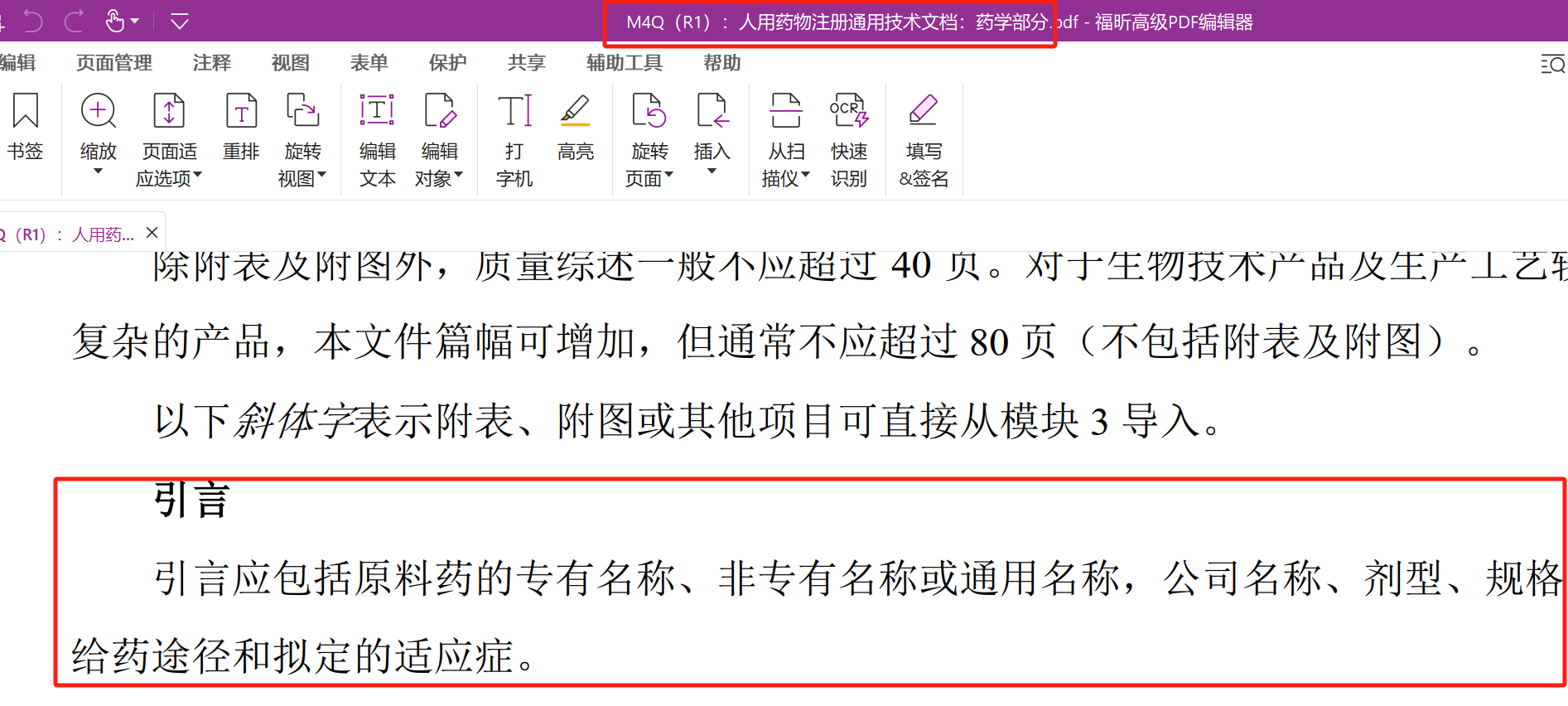
模块2.3质量综述引言
2.3质量综述部分的引言应包括以下内容:
- 原料药信息:专有名称、非专有名称或通用名。
- 公司名称:涉及原料药生产的公司或注册申请人的名称。
- 剂型:产品的剂型。
- 规格:产品的规格信息。
- 给药途径:产品拟定的给药途径。
- 拟定的适应症:产品的目标适应症。
除了列出上述要求的信息,引言部分还应简洁明了地概述整个质量综述的主要内容和结构,为审评人员提供一份清晰的导航,使其能够快速把握注册申报资料的核心要点。具体内容的撰写应遵循国家药品监督管理局发布的最新指南和要求,以及国际人用药品注册技术协调会(ICH)的CTD相关指导原则。在准备CTD资料时,务必确保所有信息准确无误,并且与申报资料中的其他部分保持一致。
评论
匿名
提交
取消
匿名
{{item_parent.created_at}}
置顶
批准
驳回
编辑
等待审核
已驳回
回复
{{item_parent.show_reply_list ? '收起回复' : '查看回复'}}({{item_parent.children.length}})
编辑
提交
取消
写回复
匿名
提交
取消
{{item_children.from_user}} 回复 {{item_children.to_user}}
{{item_children.created_at}}
批准
驳回
编辑
等待审核
已驳回
回复
编辑
提交
取消
写回复
匿名
提交
取消
这{{threadTextType}}正{{isAdminText}}
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因: