以下回答由识林AI协助
在产品加速考察时,如果数据出现不合格,应立即停止试验并详细记录下所有相关信息。然后,需要对不合格的原因进行深入调查,可能的原因包括试验条件的变化、样品的质量问题等。
一旦找出了不合格的原因,就需要采取相应的纠正和预防措施。例如,如果是由于试验条件的变化导致的,那么可能需要重新设置试验条件;如果是由于样品的质量问题,那么可能需要更换样品或者改进生产流程。
同时,还需要对这次不合格的情况进行详细的报告,并将报告提交给相关的质量管理部门。这样,他们可以根据报告的内容来决定是否需要对产品进行进一步的测试或者调整产品的有效期。
你这个说的是II区的稳定性吧,根据国内外的相关指南,这个情况都是不能被接受的,一般情况下如果不是100%保证稳定性能过的情况,都会放置中间条件稳定性,一旦加速不合格就转到中间条件进行稳定性考察,这个情况如果没有放置中间条件的稳定性样品就只能重新放了。
参考:
9001 原料药物与制剂稳定性试验指导原则
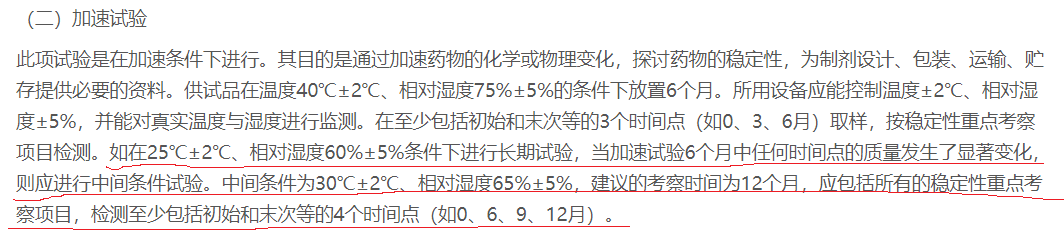
当加速试验6个月中任何时间点的质量发生了显著变化,则应进行中间条件试验
ANDAs: Stability Testing of Drug Substances and Products, Questions and Answers Guidance for Industry
Q3(ii): 如果加速条件失败,什么时候开始中间条件稳定性研究?
A3(ii): ANDA 申请人应同时开始加速、中间、长期稳定性研究,这样如果加速稳定性研究失效就可以在提交时获得所有数据。
Q3(iii): 如果加速条件下三批中有一批出现重大变化,应该怎么办?
A3(iii): 如果加速数据显示在一个或多个批次有任何属性的重大变化或失效,申请人应提交所有三个批次的中间数据。此外,提交文件应包含失效分析(即,关于观察到的失效的讨论)。
- 加速稳定性试验:条件应高于长期稳定性试验条件,用于加快降解反应的速度,使得相应的质量变更发生在早期阶段。加速稳定性试验通常用于对药品长期稳定性的预测。
- 贮存条件的确定:应综合影响因素试验、加速试验和长期试验的结果,同时结合药品受流通过程中可能遇到的情况进行综合分析。选定的贮存条件应按规范术语描述。
- 包装材料/容器的确定:一般先根据影响因素实验结果,初步确定包装材料和容器,结合加速试验和长期试验的稳定性研究的结果,进一步验证采用的包装材料和容器的合理性。
- 有效期的确定:药品的有效期应综合加速试验和长期试验的结果,进行适当的统计分析得到,最终有效期的确定一般以长期试验的结果来确定。
这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因: