3个回答
建议:可以一起变,
根据2017年第100号文和一致性评价受理审查指南提到,处方工艺是否有变更应在申请时区分说明,分别见附图1和图2,由此可知,可以同时变更原辅包供应商。另外实操也是可以的,没有任何问题。
图1:

图2:

依据:
总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)
国家药监局关于重新发布药品注册收费标准的公告(2020年 第75号)
思考:
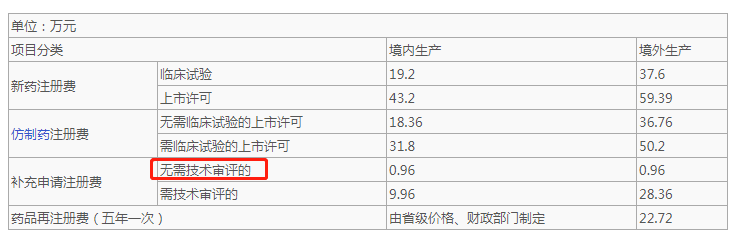
如果不改变处方工艺,仅仅只是变更A状态的原辅包供应商,且不涉及标准、说明书等修订,可以评估按微小自行变更,再申报一致性,可以按无需技术审评项收费。
但是一旦有涉及任何需要技术审评的,则按需技术审评要求收费。
评论
匿名
提交
取消
匿名
{{item_parent.created_at}}
置顶
批准
驳回
编辑
等待审核
已驳回
回复
{{item_parent.show_reply_list ? '收起回复' : '查看回复'}}({{item_parent.children.length}})
编辑
提交
取消
写回复
匿名
提交
取消
{{item_children.from_user}} 回复 {{item_children.to_user}}
{{item_children.created_at}}
批准
驳回
编辑
等待审核
已驳回
回复
编辑
提交
取消
写回复
匿名
提交
取消
这{{threadTextType}}正{{isAdminText}}
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
