不能严格对应,只是大致类似。具体的还应该根据指南的具体要求进行。
比较熟悉美国的变更要求,推荐参考的指南如下:
- Changes to an Approved NDA or ANDA
- SUPAC-IR: Immediate ReleaseSolid Oral Dosage Forms Scale-Up and Postapproval Changes: Chemistry, Manufacturing, and Controls; In Vitro Dissolution Testing and In Vivo Bioequivalence Documentation
- CMC Postapproval Manufacturing Changes To Be Documented in Annual Reports
- Changes to an Approved Application forSpecified Biotechnology and Specified Synthetic Biological Products
只能说三个监管机构对变更的管理思路是类似的,且都根据风险大小划分成了3个大的层级:最小的可以只在年报登记,最大的必须经过监管机构批准后才能开始,以及中间的一层。而有的监管还会把中间一层的再做划分。因此在形式上就不是严格意义的对应。
第二,三个监管机构自己的结构就是不同的,FDA的中等变更虽然也是备案,但仍然是提交给FDA。而中国的中等变更的备案是提交给省局并非NMPA,这说明两个监管机构对变更的风险分级标准还是不一样的。因此从细节看FDA的Moderate与中国的中等变更性质不完全相当。
第三,既然风险分级标准不同,各个监管机构对具体的一个变更情形应该归属于哪一级变更也会是不一样的。
因此,不能把某一个监管机构明确的某一变更情形的级别直接套在另一个监管机构的划定级别。
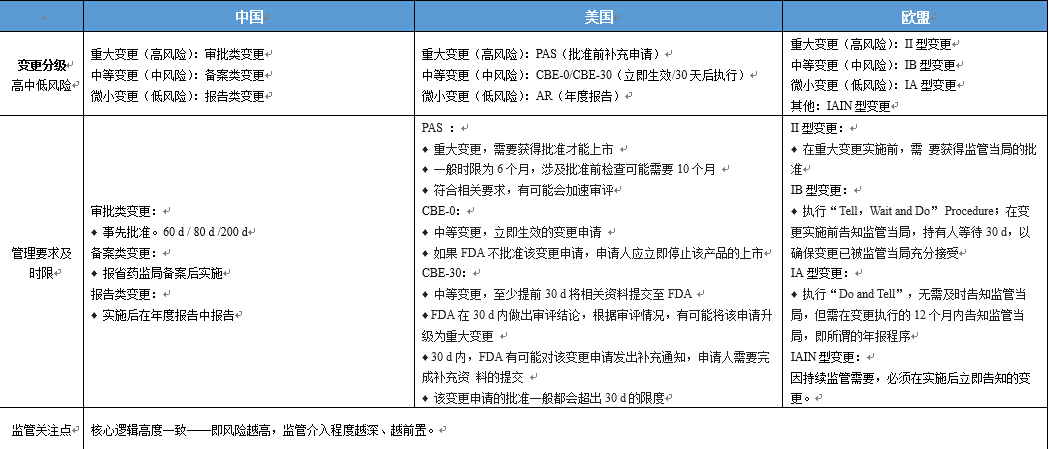
变更分类大体对应关系如下(EU的变更分类在去年有变化,表中未反映),但申报要求不太可能完全对应。变更的监管趋同一直是ICH、WHO等组织致力的方向,但长路漫漫~

来源:结合中美欧的上市后变更管理制度浅谈我国新版上市后化药变更更指导原则 中国医药工业杂志{J]. 2022, (07): 1056 -1061
首先,我建议对于三个监管机构的任何概念都不应“严格”对应,仅作为参考。正好最近做了个调研,大家指正。
对于中国NMPA监管下的变更:
- 【微小变更,可提交年报】
- 【中等变更,需备案】
- 【重大变更,需补充申请】
对于美国FDA监管下的变更:
- 【Minor,即微小变更,可提交annual report,即年报】
- 【Moderate,即中等变更,实施前提交CBE0或CBE30】
- 【Major,即重大变更,需提交Prior Approval Supplement】
对于欧盟EMA和EDQM监管下的变更:
- 【Type IA或IAIN,相当于微小变更,可按notification(通知或立即通知)处理】
- 【Type IB,相当于中等变更,需实施前申请并等待30天】
- 【Type II,相当于重大变更,需提交Application】
上述分级和申报路径仅供参考,依据如下:
中国NMPA:
纲领文件《药品上市后变更管理办法(试行)》其实没有明确:
“法律、法规、指导原则中明确为重大变更或持有人确定为重大变更的,应当按照有关规定批准后实施。与药品监管部门沟通并达成一致后降低变更管理类别的变更,应当按照达成一致的变更管理类别申报备案或报告。法律、法规、技术指导原则中明确为备案、报告管理的变更或持有人确定为备案、报告管理的变更,应当按照有关规定提出备案或报告。”
这段原文有些同义反复的意思,但在具体文件(如《已上市化学药品变更事项及申报资料要求》)中可找到依据。对应关系是:
- 重大变更:补充申请
- 中等变更:备案
- 微小变更:年报
美国FDA
FDA对于变更的对应关系是:
- Major Changes:Prior Approval Supplement(批准前增补,也就是补充申请)
- Moderate Changes:Supplement - CBE0, CBE30(分别表示“实施前提交增补即可实施”和“实施前提交增补等待30天后实施”,也就是备案)
- Minor Changes:Annual Report(即年报。)
欧盟EMA
欧洲的变更级别包含IA, IAIN,IB 和II,其变更分级和递交类别概念其实是重合的。
根据其变更法规,对应关系是:
- Type II:Major
- Type IB:Minor,可理解为中美的中等和moderate。
- Type IA:Minor,可理解为中美的“微小”
- Type II:Major:Application(需申报预先批准。类似补充申请)
- Type IB:Minor:Notification(通知,变更实施前发出,且等待30天。类似备案。)
- Type IA:Minor:Notification(通知,变更实施后12个月内提交。类似年报。但有种特殊的IAIN,即IA类,但是必须实施后马上通知,可类比为美国的CBE0,但又有微妙不同)
EDQM的CEP(主要用于API)
和上面说的欧洲相似,只不过名称换了一下。CEP分类对应关系是
- major (MAJ):Major revision(需申报预先批准。类似补充申请)
- minor (MIN):Minor revision(需申报预先批准,从受理到审评结束30天。)
- immediate notification (IN):Notification:即时通知
- annual notification (AN):Notification:通知
这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因: