请教:1.产品检验用的qpcr试剂盒厂家变更(试剂盒检测原理未变,操作步骤顺序有变化)需要对该新试剂盒检测产品的方法 重新做方法学验证或确认吗?
2.科研型试剂盒(非医疗器械、非药品)和 已有注册证、备案或批准文号的试剂盒,首次购入后试剂盒生产商(A)仅能提供试剂盒的COA,需要药品企业(B)重新做该试剂盒的确认吗?若试剂盒生产商(A)提供该批次试剂盒的验证报告,药品企业(B)可以不做试剂盒的确认吗?同款试剂盒其他批次的试剂盒,对于药品企业(B)来说,一次验证或确认就可以,还是每个批次都一个验证或确认?
1. 不知道你说的原理没有改变,是否包括了试剂盒里的引物、探针这些试剂也没有改变。(虽然很大可能是不一样了)。PCR不同于那些理化方法,试剂盒即方法。从qPCR的原理来说,引物的序列、探针的结合能力、荧光系数等都直接决定了这个试剂盒方法的专属性、定量限等方法学性能。因此如果这些改变了,需要重新做方法的验证或确认。
2. 是否要做验证不是取决于它是什么等级具有什么注册资质,而是看它在用于什么场景。无论是科研级还是已上市批准的,用于GMP下的检验都需要用企业B做确认。反过来没有达到商业化阶段,可以根据情况选择先不做验证。
由于厂家A的验证时用的样品肯定不会是企业B自己的产品,所以A的验证报告不能证明适用于B就一定符合要求。因此B需要自己用样品进行方法学验证。
商品的基本要求都是批次质量相同,试剂盒也不例外。所以B在做验证时要验证的是试剂盒内的各试剂在设计上就能保证形成的分析过程的性能,这是一种在性能上的验证。而不是对试剂盒的质量的验证。试剂盒的质量不变是通过质量系统的供应商管理去实现的,这不是方法学验证的范畴。
问的方法/技术(qPCR)过于具体,不便于直接回答,下面仅提供一个思路:
试剂盒类方法的验证通常包括两部分:1. 试剂盒厂家的基础验证;2. 产品特异的验证。以定量法细菌内毒素检测举例如下(仅举例,如下所示,不同厂家在基础验证包中所做的验证内容并不完全一致)。
例1:
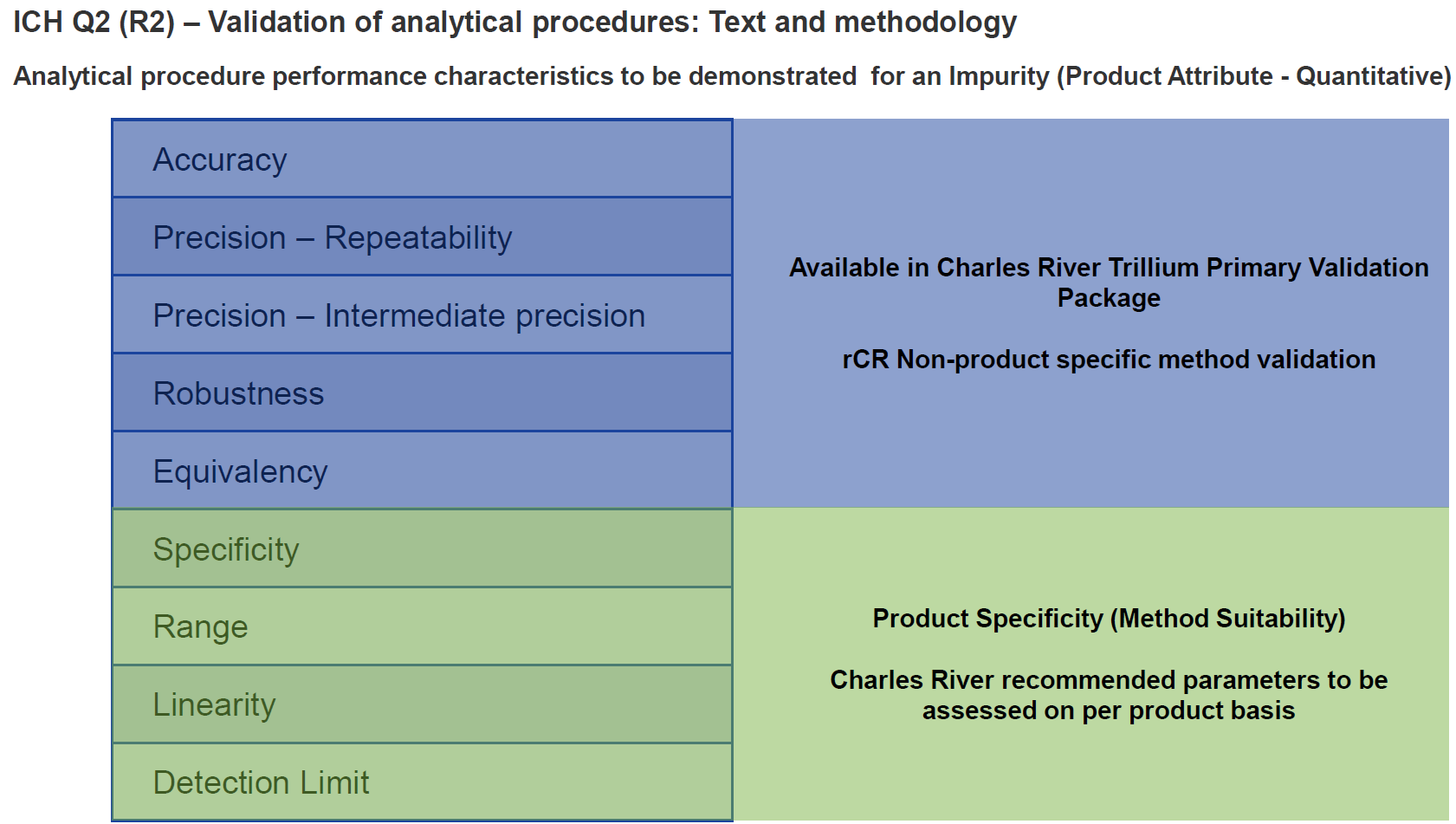
例2:
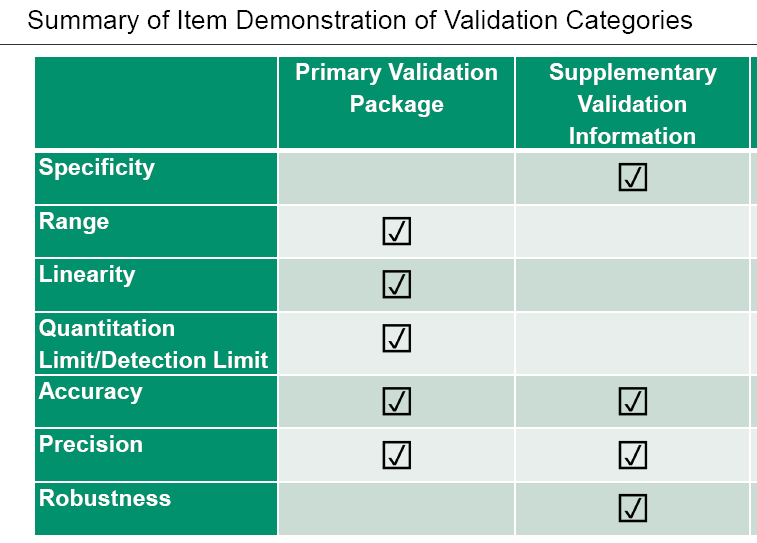
问题1:在厂家都能提供基础验证包的情况下,做产品特定的验证内容就可以了。但应注意,涉及到方法变更,仅做验证是不够的,需要用代表性产品做方法比对(或桥接)。
问题2:(1) 试剂盒生产商(A)仅提供COA,不能提供基础验证包时,药品企业(B)需要进行全面的方法验证,但不是重复试剂盒的确认,即两部分验证重叠的部分(如精密度、准确度)直接用产品做即可。
(2)试剂盒生产商(A)提供试剂盒的验证报告,药品企业(B)不需要做试剂盒的全面确认,仅需要做产品特定的验证内容。
(3)试剂盒生产商(A)有责任保证试剂盒的批间一致性/连续性,否则不应纳入合格供应商目录。药品企业(B)应建立关键试剂的管理程序,通过用代表性样品进行必要的用户验收测试来确保每一批关键试剂的可靠性(注意:不是做全面的试剂盒确认)。
这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
