2024年2月16日,FDA加速批准 Iovance Biotherapeutics公司 TIL(肿瘤浸润淋巴细胞)疗法 Amtagvi(lifileucel)上市,用于治疗晚期黑色素瘤,用于治疗之前接受过其他疗法(PD-1阻断抗体,以及如果BRAF V600突变阳性,BRAF抑制剂联合或不联合MEK抑制剂)的无法通过手术切除(不可切除)或已扩散到身体其他部位的皮肤癌(黑色素瘤)的成年患者。

Amtagvi(lifileucel) 成为全球首款获批上市的 TIL 细胞疗法 , 也是首款获批治疗实体瘤的 T 细胞疗法,具有里程碑式的意义;同时,其显著疗效为令 CGT 领域从业者颇受振奋,为 寒冬中备受挫折的行业增添了暖意提振了士气。
更多关于Amtagvi(lifileucel)产品的介绍可参考:
- 资讯,FDA 批准首个实体瘤个体化 T 细胞疗法。
- 资讯,FDA 批准首个治疗不可切除或转移性黑色素瘤的细胞疗法。
- 资讯,FDA 准予 lifileucel 加速批准以治疗不可切除或转移性黑色素瘤。
- 审评资料,Amtagvi(lifileucel):Package Insert - AMTAGVI,February 16 2024 Approval Letter - AMTAGVI
TIL疗法后续会面临哪些挑战?
- 同已获批的CAR-T等疗法一样,TIL疗法也会面临,包括如何缩短制备时间,如何降低生产成本,如何改善以及评价活性细胞的效能,如何成功的商业推广,如何定价(Amtagvi定价51.5万美元,比当前市场上任何一种CAR-T昂贵)以及采取什么样的支付策略等;
- 另外,与外周血采集不同,TIL来源与患者的肿瘤组织;由于,当前TIL疗法适用于后线不可切除性或转移性肿瘤,那么会遇到采集什么位置的肿瘤组织,采集量要求以及如何采集肿瘤组织(穿刺 or 手术,需要考虑患者免疫系统已经减弱很多)等等问题,这给组织采集造成了挑战。
- 等等
什么是TIL (肿瘤浸润淋巴细胞) 疗法?
在肿瘤发展过程中,体内的免疫细胞会针对肿瘤细胞发挥杀伤作用,不同的免疫细胞(主要是淋巴细胞)经运输抵达肿瘤部位,这些 已离开血液迁移到肿瘤组织的淋巴细胞即肿瘤浸润免疫细胞(TILs),包括 T 细胞、B 细胞、NK细胞等多种单核和多核免疫细胞,并以不同的比例组成, 可以识别、攻击和杀死癌细胞。 其中多形核细胞包括但不限于:T细胞、B细胞、NK细胞(natural killer cells)、树突状细胞(dendritic cells)、巨噬细胞(macrophages)、中性粒细胞(neutrophils)、嗜酸性粒细胞(eosinophils)、嗜碱性粒细胞(basophils)。 TILs 是肿瘤浸润免疫细胞(Tumor-infiltrating immune cells)的其中一类细胞。TILs 通常可以在肿瘤间质和肿瘤本身中找到,它们的功能会在整个肿瘤进展过程中动态变化,并对抗癌治疗作出反应。TILs 的存在通常与更好的临床结果相关(手术或免疫治疗后)。
TILs 疗法是指在从患者的肿瘤组织中分离出肿瘤浸润淋巴细胞,经筛选及离体扩增后,然后回输到患者体内,帮助免疫系统杀死癌细胞。TILs 疗法在实体肿瘤治疗中表现出较强的疗效,在黑色素瘤、宫颈鳞状细胞癌、胆管癌等多种癌症中均可引起客观肿瘤消退。
持续更新内容请参考:主题词-TIL。
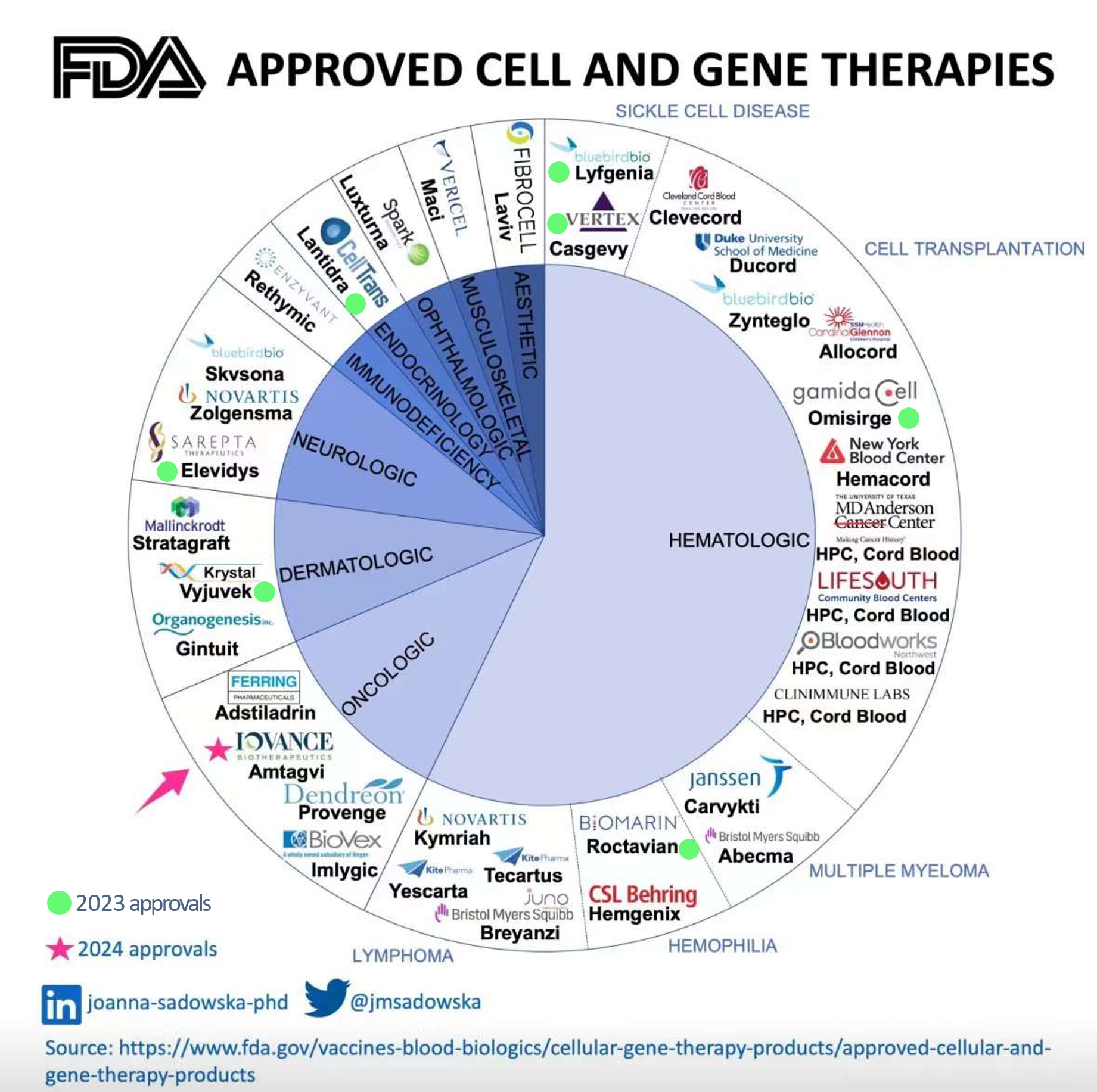
截至2024年2月16日,FDA 批准的细胞和基因治疗产品,详见下图。
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
