外泌体是细胞释放的纳米级囊泡,粒径介于30~150nm之间,属于细胞外囊泡(EV)的一种。它们参与DNA、RNA、蛋白质和其他细胞成分的细胞间通讯和交换过程。已有报道,外泌体可作为标记物用于疾病诊断,或作为有效载体参与调控靶细胞功能或细胞生物学活动等过程,在临床上取得了一定的成果。然而,将外泌体推向临床应用的一个主要瓶颈,是目前尚没有一种提取方法能够同时满足高效、高产量、高纯度、保持外泌体完整性的要求。最常用的外泌体提取方法是超速离心法,该方法技术成熟、产量高,适用于大体积样本,但回收率和纯度低。因此使用高通量和高质量的鉴定以及定量方法,是外泌体研究的重要一环,对确保研究结果的可信度及可重复性十分重要。
外泌体的鉴定主要围绕颗粒形态、粒径大小、浓度、抗原表达等维度展开。常使用的鉴定方法包括显微镜法、纳米颗粒跟踪分析(NTA)、动态光散射(DLS)、蛋白质印迹法(WB)、酶联免疫吸附测定(ELISA)和流式细胞分析(FCM)等。
一、外泌体的物理表征
1.1 显微镜法
显微镜法被广泛用来观测EV的物理特征,双层囊膜结构是外泌体的重要标志之一,但传统的光学显微镜由于接近EV大小的衍射极限,难以生成清晰图像,可使用高分辨率的电子显微镜(EM)或原子力显微镜(AFM)来进行观测,如图1。
常用的鉴定仪器为透射电子显微镜(TEM)和扫描电子显微镜(SEM)。TEM具有卓越的分辨率,达0.1~0.2nm,可观测到样品内部结构和形貌,也可与免疫标记联用进行分子表征。SEM的分辨率<1nm,可观测到样品表面微观形貌,但不能分析异质外泌体群体,多分散样品成像条件苛刻,且通量低。
TEM/SEM方法对样品的预处理和制备要求较高,样品脱水和固定会对尺寸和形貌造成影响。冷冻电子显微镜(cryo-EM)可以保持样品完全水合并且被快速分析,无需进行大量的前处理,避免脱水和化学固定剂造成的影响。但是冷冻的样品在鉴定标志蛋白时会带来操作不便,以及影响检测结果。
原子力显微镜(AFM)同样具有高分辨率,可用来测量外泌体在生理状态下的相对尺寸大小,能够提供关于表面拓扑结构和局部材料特性(如高度、附着力)等信息。该方法灵敏度高、样品制备简单且快速,但吞吐量低且价格较昂贵。

图1 EV的显微照片。(a)SEM;(b)TEM;(c)cryo-EM;(d)AFM
1.2 纳米颗粒跟踪分析(NTA)
纳米颗粒跟踪分析(Nanoparticle Tracking Analysis,NTA)是一种光学粒子跟踪方法,用于确定纳米颗粒的浓度和尺寸分布。使用光束照射样品中的颗粒,当颗粒散射光并进行布朗运动时,高速相机会记录每个粒子的路径以确定平均速度和扩散率,然后使用此信息以数学方式计算EV浓度(即视野中粒子数,图2a)和尺寸分布(即通过Strokes-Einstein方程得出的流体力学直径,图2b)。

图2 纳米颗粒追踪分析(NTA)EV随时间的散射(a)并计算EV浓度和粒径(b)
NTA技术具有易用、快速、稳健、准确等优点,可以对10-2000nm范围内的纳米颗粒进行快速实时动态检测,保证了外泌体的原始状态。测量参数包括颗粒粒径、散射光强、浓度等,可对提取的外泌体进行粒径大小及数量统计,以及初步质量评估。
可调电阻脉冲感(Tunable Resistive Pulse Sensing,TRPS)是NTA的一种替代方法,用于测量EV的浓度和尺寸分布,但适用于粒径大于150nm的EV。对于小尺寸的外泌体,NTA始终能够比TRPS检测到更多粒子,结果更为准确。
1.3动态光散射(DLS)
动态光散射(Dynamic Light Scattering,DLS),是另一种检测EV粒径及浓度的技术。DLS的工作原理是单色相干激光束通过颗粒悬浮液,当颗粒进行布朗运动时,来自所有颗粒的散射光会(建设性和破坏性地)干涉,并引起散射强度随着时间而波动。颗粒的动态信息来源于实验过程中记录的强度轨迹的自相关 (图3a)。波动率可以通过Strokes-Einstein方程转换为颗粒的扩散系数,用于确定流体力学直径(即流体中的有效粒径,图3b)。DLS方法使用起来很简单,但不能将粒子形象化。
DLS的优点是它能够测量从1nm到6µm大小的颗粒,最适合于测量悬浮液(单分散悬浮液)中的颗粒。但是DLS只能检测浓度较高的样品,当浓度较低时,NTA方法能更好地完成检测。此外,DLS原始测量的是光强波动数据,大颗粒的光强波动信号会掩盖较小颗粒的信号,不适合大小不一的复杂外泌体样本的测量。为了发现这种失真,还应比较从强度分布中数学推导出来的数字分布,以保持一致性(图3b)。

图3 动态光散射(DLS)检测EV经历连续布朗运动时的动态信息(a)并计算浓度与粒径(b)
二、外泌体标志蛋白的鉴定
外泌体膜上富含参与外泌体运输的四跨膜蛋白家族(CD63、CD81和CD9)、热休克蛋白家族(HSP60、HSP70、HSPA5、CCT2和HSP90)、多泡小体合成蛋白(TSG101和ALIX)以及一些细胞特异性的蛋白包括A33(结肠上皮细胞来源)、MHC-II(抗原提呈细胞来源)、CD86(抗原提呈细胞来源)和乳凝集素(不成熟的树突状细胞)。这些标志蛋白主要涉及囊泡的形成和分泌过程,其中CD63、CD9、CD81以及TSG101、HSP70、ALIX等是最常用到的EV标志物。因此,除了物理表征外,外泌体标志蛋白的鉴定也是必要检项。
2.1 蛋白质印迹法(WB)
蛋白质印迹(Western Blot,WB),也称免疫印迹,是最常用的鉴定EV相关蛋白质的分析技术。提取获得的外泌体用含有变性剂和蛋白酶抑制剂的缓冲裂解液处理,蛋白质裂解物通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,之后转移到膜上并与特异性抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测特定的蛋白质靶标(如图4a)。该方法虽然前处理过程繁琐且时间长(大于10小时),但WB能够提供不同大小蛋白质的富集情况,具有灵敏性高、特异性好及分辨率高等优点,可以对外泌体标志蛋白质进行定性和半定量分析。
2.2 酶联免疫吸附测定(ELISA)
酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)是另一种技术相对成熟的蛋白质定量技术。EV或EV裂解物可以直接与包被于固相载体上的特异性抗体(捕获抗体)结合,然后将捕获的EV暴露于另一种酶标记特异性抗体(如图4b)。酶与底物发生显色反应,底物降解量即为欲测蛋白质的量。
ELISA比WB检测灵敏度高、操作便捷、速度快,可以放大以进行更高通量的测量。但是该方法需要一对非相互作用的抗体,对检测特异性要求更高,使得开发新的检测方法或同时执行多个检测任务变得困难。因此,ELISA只能分析个别水平的外泌体。
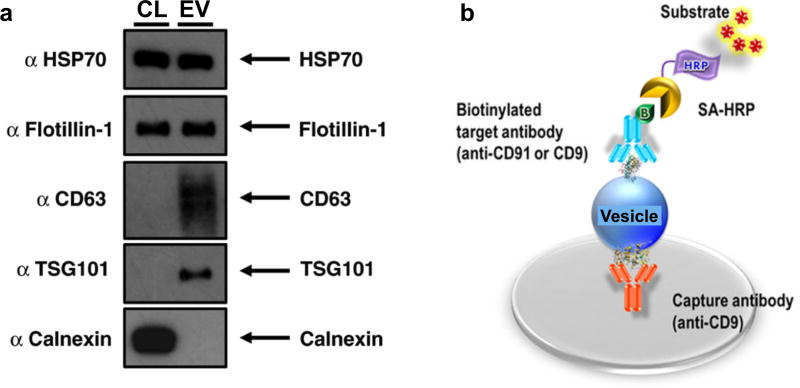
图4 常规EV蛋白分析。(a)WB;(b)ELISA
2.3 流式细胞术(FCM)
流式细胞术(Flow cytometry,FCM)是以高能量激光照射高速流动状态下被荧光色素染色的单细胞或微粒,测量其产生的散射光和发射荧光的强度,从而对细胞(或微粒)的多种物理或生物学特征及功能进行定性或定量检测的一种细胞分析技术。
FCM具有所需样本浓度较低、快速、高通量、多参数检测等优点,针对外泌体检测,能够同时检测粒径和标志蛋白,非常适合即时检测。但是传统的FCM方法检测下限为500nm左右,外泌体的粒径太小,折射率低于常规FCM仪器分析的阈值,因此不能准确区分粒子与噪声。为了优化检测阈值,常将外泌体与微珠连接以增大表面积、增强反射,或者加入纳米金颗粒来增加外泌体粒径之后再检测。但是正在开发的高分辨率的FCM仪器,也仅能区分低至100nm的颗粒,不能分辨更小的外泌体,分辨率与准确性有待提升。
三、外泌体质控的基本要求
国际胞外囊泡学会(ISEV)曾在2014年提出EV(包含外泌体)及其功能研究的基本实验要求(MISEV2014),并在2018年进行了修订(MISEV2018)。在鉴定方面,建议通过互补的技术对EV表征进行相互印证,以提高鉴定结果的准确性,排除非EV的干扰。
3.1 EV的定量
EV的定量是MISEV2018相较于MISEV2014新补充的内容,指出需要对EV的来源和EV样品进行定量描述,在可能的范围内表征以确定EV的丰度。EV具有颗粒结构并含有蛋白质、脂质、核酸或其他生物组分,其中任一种组分的定量均可作为EV量化的代表。建议至少通过2种定量方法测定总颗粒数、总蛋白含量或总脂质含量,以每初始生物流体体积或外泌细胞数量/组织质量表示。此外,还建议检测非EV等共同分离组分的存在。
3.1.1 总粒子数
针对较小尺寸EV的外泌体,总粒子数建议使用NTA或高分辨率的FCM方法。其他方法,如常规FCM和TRPS适用于较大尺寸EV的检测,DLS仅对单分散样品检测准确,需结合实际试验需求选择。
3.1.2 总蛋白质
蛋白质含量可以通过各种比色分析[Bradford或micro-bicinchonic acid(BCA)]、荧光分析,或通过SDS-PAGE上的全局蛋白质染色等方法来测量。然而,由于共同分离的蛋白质污染物(例如来自培养基或血浆/血清的白蛋白),蛋白质定量可导致过高估计,特别是当使用不太特异的EV分离方法时。相反的,如果是高度特异性的方法产生的高纯度EV样品,则可能由于不够灵敏导致检测值低于实际水平。此外,结果可能根据使用或不使用洗涤剂(测定之前破坏EV并暴露整个蛋白质含量)而变化;因此必须指明洗涤剂的性质和浓度。
3.1.3 总脂质
可以使用Sulfo-phospho-Vanillin分析,通过测定仅在掺入直至双层(如DiR)时才发出荧光的磷脂染料,或通过全反射傅里叶变换红外光谱等方法测定总脂质含量。但是后者需要专门的设备,并且对于测定少量EV中的第1类和第2类蛋白可能不够灵敏。此外,还必须确定这些技术是否能够独立于特定脂质成分检测所有的EV。
3.2 蛋白质组成表征
表1列出了用于表征的蛋白类别和一些示例。第1类用于表征EV中存在脂质双分子膜;第2类用于表征EV样品中具有膜或受体结合能力的蛋白;第3类是一些非EV结构的主要蛋白成分,通常与EV共同分类,评估它们有助于评估EV样品的纯度。因此,任何EV(包括外泌体)必须对EV样品中1至3类中的至少一种蛋白进行评估(至少每次修改分析前和/或EV分离条件时)。前两类为阳性标志蛋白,第3类为阴性标志蛋白。
当研究重点约束在如粒径小于200nm的小型EV亚型,则应评估另外一类蛋白(第4类),它们存在于一些EV中,但在粒径小于200nm的EV上很少存在。当需要研究EV中已确认存在的功能性可溶性因子(第5类)时,建议对第5类蛋白进行分析,确认其与EV的关联模式。
最常用的分析方法是蛋白质印迹法(WB)。此外,还可以使用高分辨率的FCM(如流式细胞荧光分选术,FACS)或使用质谱技术分析如跨膜蛋白的全局蛋白质组。建议以半定量的方法进行分析,例如使用WB信号的强度分析或特定的平均荧光水平,与FCM进行同型对照比较。当分析体外培养细胞分泌的EV时,理想情况下最好将它们的组成与分泌细胞的组成进行比较,以确定EV组分的富集水平。考虑到定量研究中使用的商业或自制抗体的质量参差不齐,适当的阴性对照也应被检测。
3.3 单EV表征
建议对混合物中的单个EV进行表征,以表明所研究EV的异质性。通过至少2种方法来分析EV,例如:(1)通过可视化的电子显微镜或相关技术、扫描探针显微镜(SPM)(包括AFM)、或超分辨率显微镜等观测颗粒形态,并同时显示特写视野和广角视野;(2)使用高分辨图像以外的方法以表征EV的生物物理特征,尺寸大小可通过基于电场位移的TRPS,基于光散射特性的NTA、高分辨FCM、多角度光散射耦合不对称流场流分馏(AF4-MALS),或基于荧光特性的荧光相关光谱(FCS)、高分辨率FCM等方法测定;使用拉曼光谱方法测量化学成分。之后将检测结果与显微镜观测结果进行比较,因为它们不能将EV和类似大小的非膜颗粒区分开来。
表1 基于蛋白质含量的EV表征。必须对类别1a或1b、2a(可选2b)、3a或3b中的至少一种蛋白质进行分析,以证明EV的性质和EV样品的纯度。在要求对小型EV进行特定分析时,需要分析第4类蛋白质,并需要分析第5类蛋白质以记录功能活动。提供了在哺乳动物细胞来源的EV中常见的蛋白质的例子,但可以使用其他属于所提供类别的蛋白质,特别是用于分析来自原核生物(细菌)或非哺乳动物真核生物来源(包括寄生虫和植物)的EV。XX=人类基因名称。XX *或XX **用于多个蛋白质家族,例如整合素:ITGA *表示任何整合素α链。
参考文献:
[1]Shao, Huilin, Hyungsoon, et al. New Technologies for Analysis of Extracellular Vesicles[J]. Chemical Reviews, 2018.
[2]龚春梅, 徐远飞, 周继昌. 外泌体分离与鉴定方法的研究进展[J]. 生命科学, 2018, 030(003):319-326.
[3]Liang Y , Duan L , Lu J , et al. Engineering exosomes for targeted drug delivery[J]. Theranostics, 2021, 11(7):3183-3195.
[4]Lötvall J, Hill A F, Hochberg F, et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: a position statement from the International Society for Extracellular Vesicles[J]. 2014.
[5]Théry C, Witwer K W, Aikawa E, et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines[J]. Journal of extracellular vesicles, 2018, 7(1): 1535750.
[6] Mendt M , Kamerkar S , Sugimoto H , et al. Generation and testing of clinical-grade exosomes for pancreatic cancer[J]. Jci Insight, 2018, 3(8).
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
