药品专利纠纷早期解决机制是指将相关药品上市审批程序与相关药品专利纠纷解决程序相衔接的制度,也就是通常我们所说的“药品专利链接制度”。目前,从顶层政策要求,到法律依据,再到具体配套措施,均规定了有关药品注册与专利纠纷解决链接的内容,因此,我国“药品专利链接制度”已然形成。本文拟通过对药品专利纠纷早期解决机制的制度框架进行梳理,对涉及的法律实务要点进行解析,旨在为生物医药企业充分利用该制度实现创新突破提供参考。

01
顶层政策
—
2017年10月08日、2019年11月24日,中共中央办公厅、国务院办公厅先后发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》和《关于强化知识产权保护的意见》,两个意见均指出,要探索建立药品专利链接制度。
法律依据
—
2020年10月17日,第十三届全国人民代表大会常务委员会第二十二次会议通过了《全国人民代表大会常务委员会关于修改<中华人民共和国专利法>的决定》,自2021年06月01日起施行。新修订的《专利法》第七十六条增加了药品专利纠纷早期解决的有关规定,明确由国务院药品监督管理部门会同国务院专利行政部门制定药品上市许可审批与药品上市许可申请阶段专利纠纷解决的具体衔接办法,报国务院同意后实施。
03
具体配套措施
—
(一)《药品专利纠纷早期解决机制实施办法(试行)》
2021年07月04日,国家药监局、国家知识产权局发布《药品专利纠纷早期解决机制实施办法(试行)》(简称《实施办法》)。《实施办法》旨在为当事人在相关药品上市审评审批环节提供相关专利纠纷解决的机制,保护药品专利权人合法权益,降低仿制药上市后专利侵权风险。其主要包括以下内容:
(1)平台建设和信息公开
《实施办法》第二条、第三条规定,由国务院药品监督管理部门组织建立中国上市药品专利信息登记平台,供药品上市许可持有人登记在中国境内注册上市的药品相关专利信息,由国家药品审评机构负责建立并维护、公开已获批上市药品的相关专利信息。
需要注意的是,未在中国上市药品专利信息登记平台登记相关专利信息的,不适用本办法。
(2)专利权登记
《实施办法》第四条规定了对药品上市许可持有人自行登记相关专利的要求,如要在获得药品注册证书后30日内登记相关专利;要登记相关的专利号、专利名称、专利权人、专利被许可人、专利授权日期及保护期限届满日、专利状态、专利类型、药品与相关专利权利要求的对应关系、通讯地址、联系人、联系方式等内容;上市许可持有人要对其登记的相关信息的真实性、准确性和完整性负责;等等。
同时根据《实施办法》第五条、第十二条第一款的规定,可以登记的专利类型如下:

(3)仿制药专利声明
根据《实施办法》第六条的规定,化学仿制药申请人提交药品上市许可申请时应当作出四类声明,以及化学仿制药申请人的通知义务。

同时,《实施办法》第十二条第二款规定了中药同名同方药、生物类似药申请人也要按照第六条进行相关专利声明。
(4)司法链接和行政链接
根据《实施办法》第七条的规定,如果专利权人或者利害关系人对四类专利声明有异议,可以就申请上市药品的相关技术方案是否落入相关专利权保护范围向人民法院提起诉讼或者向国务院专利行政部门请求行政裁决。
需要注意的是,无论是司法途径还是行政途径,均是确认技术方案是否落入专利权保护范围之诉(请求),不是侵犯专利权之诉(请求),因为此时不存在专利法第十一条规定的情形。此外,行政裁决也不是终局裁决,当事人对行政裁决不服,可以在收到行政裁决书后依法向人民法院起诉。
(5)批准等待期
根据《实施办法》第八条的规定,国务院药品监督管理部门对侵犯专利权与否有争议的化学仿制药注册申请,自人民法院立案或者国务院专利行政部门受理之日起设置一次9个月的等待期,等待期内国家药品审评机构不停止技术审评。
需要注意的是,如果专利权人或者利害关系人未在规定期限内将争议提交司法或行政途径解决,国务院药品监督管理部门会根据技术审评结论和仿制药申请人提交的声明情形,直接作出是否批准上市的决定;仿制药申请人也可以按相关规定提起诉讼或者请求行政裁决以确认不侵权。
(6)药品审评审批分类处理
根据《实施办法》第九条的规定,对引发等待期且通过技术审评的化学仿制药注册申请,国家药品审评机构会结合人民法院生效判决或者国务院专利行政部门行政裁决作出相应处理。
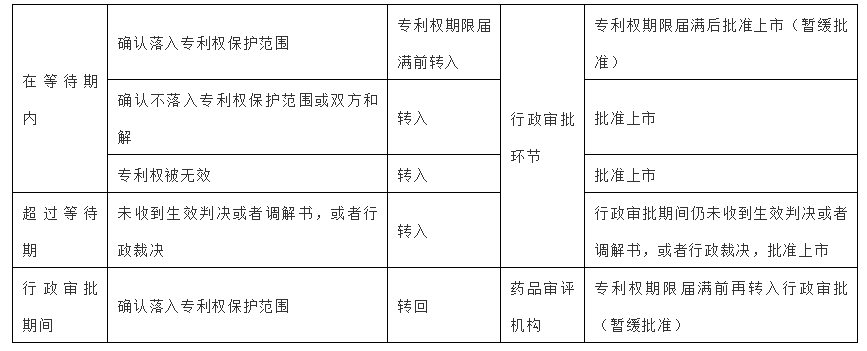
需要注意的是,对于暂缓批准,如果人民法院推翻原行政裁决、双方和解、相关专利权被宣告无效,以及专利权人、利害关系人撤回诉讼或者行政裁决请求,仿制药申请人可以向国务院药品监督管理部门申请批准仿制药上市,国务院药品监督管理部门可以作出是否批准的决定。
(7)首仿药市场独占期
根据《实施办法》第十一条的规定, 给予化学仿制药市场独占期要同时具备两个条件:首个挑战专利成功;首个获批上市。市场独占期限不超过被挑战药品的剩余的专利权期限。除共同挑战专利成功外,国务院药品监督管理部门在该药品获批之日起12个月内不再批准同品种仿制药上市。
需要注意的是,市场独占期内虽不再批准同品种仿制药上市,但是不停止技术审评。对技术审评通过的化学仿制药注册申请,待市场独占期到期前将相关化学仿制药注册申请转入行政审批环节。
(8)中药同名同方药和生物类似药注册申请的例外
根据《实施办法》第十三条的规定,中药同名同方药和生物类似药注册申请,不设置等待期,依据技术审评结论,国务院药品监督管理部门将直接作出是否批准上市的决定。
需要注意的是,如果该注册申请的药品的相关技术方案,由人民法院或者国务院专利行政部门确认落入了相关专利权的保护范围,则该药品在相应专利权有效期届满之后方可上市。
(二)《最高人民法院关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》
2021年07月05日起《最高人民法院关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》施行(简称《若干规定》)。该《若干规定》由最高人民法院审判委员会第1839次会议于2021年05月24日通过。
(1)专属管辖
根据该《若干规定》第一条的规定,当事人依据专利法第七十六条规定提起的确认是否落入专利权保护范围纠纷的第一审案件,由北京知识产权法院管辖。
(2)药品上市许可申请人可提起确认不侵权之诉
根据该《若干规定》第四条的规定,专利权人或者利害关系人在规定的期限内(自国家药品审评机构公开药品上市许可申请之日起45日内)未向人民法院提起诉讼的,药品上市许可申请人可以向人民法院起诉,请求确认申请注册药品未落入相关专利权保护范围。
(3)先行的行政程序不影响司法程序
根据该《若干规定》第五条、第六条的规定,行政裁决先行受理的,不能对抗人民法院再后受理诉讼或者已受理的,不予中止诉讼。人民法院受理诉讼后,以国务院专利行政部门已经受理宣告相关专利权无效的请求为由,申请中止诉讼的,人民法院一般不予支持。
(4)确认之诉中,药品上市许可申请人可主张现有技术(设计)或先用权不侵权抗辩
根据该《若干规定》第七条的规定,药品上市许可申请人主张具有专利法第六十七条、第七十五条第二项等规定情形的,人民法院经审查属实,可以判决确认申请注册的药品相关技术方案未落入相关专利权保护范围。
(5)行为保全的适用
根据该《若干规定》第十条的规定, 在确认之诉中,专利权人或者利害关系人可以请求人民法院依法裁定禁止药品上市许可申请人在相关专利权有效期内实施专利法第十一条规定的行为;但是,不能请求人民法院裁定禁止药品上市申请行为或者审评审批行为。
(6)同案同判及例外
根据该《若干规定》第十一条的规定,如果依据专利法第七十六条所产生的诉讼,其判决已生效,那么,在针对同一专利权和申请注册药品的侵害专利权或者确认不侵害专利权诉讼中,当事人可以主张依据该生效判决认定涉案药品技术方案是否落入相关专利权保护范围。
需要注意的是,如果有证据证明被诉侵权药品技术方案与申请注册的药品相关技术方案不一致或者新主张的事由成立,则人民法院会根据具体情况,重新查明认定事实并适用法律,作出判决。
(7)滥用诉权的规制
根据该《若干规定》第十二条的规定,如果专利权人或者利害关系人知道或者应当知道其主张的专利权应当被宣告无效或者申请注册药品的相关技术方案未落入专利权保护范围,仍提起专利法第七十六条所称诉讼或者请求行政裁决,阻碍仿制药获得批准,此时,药品上市许可申请人可以向北京知识产权法院提起损害赔偿之诉。
(三)《药品专利纠纷早期解决机制行政裁决办法》
2021年07月05日,国家知识产权局发布《药品专利纠纷早期解决机制行政裁决办法》(简称《裁决办法》),并于当日施行。
(1)国家知识产权局内设专门机构
根据《裁决办法》第二条的规定,国家知识产权局设立药品专利纠纷早期解决机制行政裁决委员会,组织和开展药品专利纠纷早期解决机制行政裁决相关工作。
(2)请求对药品专利纠纷进行行政裁决应符合的条件
《裁决办法》第四条规定了当事人请求国家知识产权局对药品专利纠纷进行行政裁决的条件,其中第(五)、(六)、(七)项规定了排除条件:
人民法院已就该药品专利纠纷立案的,则国家知识产权局不再受理行政裁决;
药品上市许可申请人提起行政裁决请求,要在国家药品审评机构公开药品上市许可申请之日起四十五日内,且专利权人或者利害关系人没有就该药品专利纠纷向人民法院起诉或者提起行政裁决请求;
一项行政裁决请求应当仅限于确认一个申请上市许可的药品技术方案是否落入某一项专利权的保护范围,如果涉及多项专利权,则要分别提起行政裁决。
(3)主体的确定
《裁决办法》第五条、第六条规定了如何确定请求人与被请求人,具体如下:

(4)审理形式
根据《裁决办法》第十三条的规定,国家知识产权局应当组成合议组审理案件,可以口头审理或者书面审理。此外,相同当事人针对同一药品相关的多项专利权提出多项行政裁决请求可以合并审理。
(5)专利权无效后的处理
根据《裁决办法》第十四条的规定,在药品专利纠纷行政裁决案件办理中,涉案专利所涉及的部分权利要求被宣告无效,则根据维持有效的权利要求为基础作出行政裁决;涉案专利所涉及的权利要求被全部宣告无效,驳回行政裁决请求。
(6)行政裁决调解的适用
根据《裁决办法》第十五条的规定,药品专利纠纷行政裁决案件,可以根据当事人的意愿进行调解。经调解,当事人达成一致意见的,可以应当事人的请求制作调解书。调解不成的,及时作出行政裁决。
(7)行政裁决中止的情形
《裁决办法》第十六条规定了药品专利纠纷行政裁决案件中止的情形,其中需要注意的是,即使是当事人对涉案专利提出无效宣告请求,国家知识产权局也可以不中止案件办理。
(8)撤回行政裁决请求的适用
根据《裁决办法》第十七条的规定,作出行政裁决之前,请求人可以撤回其请求。请求人撤回其请求或者其请求视为撤回的,药品专利纠纷行政裁决程序终止。请求人在行政裁决的结论作出后撤回其请求的,不影响行政裁决的效力。
(9)裁决事项及公开
根据《裁决办法》第十八条的规定,行政裁决应当就申请上市药品技术方案是否落入相关专利权保护范围作出认定,并说明理由和依据。裁决后,应当送达当事人并抄送国家药品监督管理部门,同时删除涉及商业秘密的信息后按照《政府信息公开条例》及有关规定向社会公开。
(10)不服行政裁决的救济
根据《裁决办法》第十九条的规定,如果当事人对国家知识产权局作出的药品专利纠纷行政裁决不服,可以依法向人民法院起诉。根据前述《实施办法》、《若干规定》的规定,确认申请上市许可的药品的相关技术方案是否落入相关专利权的保护范围之诉由北京知识产权法院管辖。此外,再根据《中华人民共和国行政诉讼法(2017修正)》第七十条的规定,行政行为有下列情形之一的,人民法院判决撤销或者部分撤销,并可以判决被告重新作出行政行为。因此,如果一方当事人对行政裁决不服,可以在收到行政裁决之日起15日内,以国家知识产权局为被告,以另一方当事人为第三人,向北京知识产权法院提起行政诉讼,请求依法撤销或者部分撤销行政裁决。北京知识产权法院认为被诉行政裁决确认申请上市许可的药品的相关技术方案落入或不落入相关专利权的保护范围的理由不能成立的,应当判决撤销或者部分撤销,并可视情判决国家知识产权局就该争议重新作出行政裁决。行政裁决系直接依据生效裁判重新作出且未引入新的事实和理由,如果当事人对该行政裁决再提起行政诉讼,北京知识产权法院将依法裁定不予受理;已经受理的,将依法裁定驳回起诉。
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
