生物制药原料(DSs)和制剂(DPs)通常被冷冻或冷藏,以保证其长期储存、搬运和运输时的稳定性。储存和运输过程中的温度偏差会对产品质量产生不利影响,影响这些分子的安全性和有效性。因此,在这些产品的整个保质期内,冷链管理是其供应链战略中的一个关键组成部分。
但是冷链管理的成本和复杂性是生物制药行业面临的一个众所周知的挑战。由于药品的行业和监管因素,使得其成本高和物流复杂。在供应链中的所有分销节点都需要足够的产品存储设备,并且必须对其进行合格鉴定、维护和持续监控。温度控制运输需要保温绝热运输箱和/或其他特殊包装,以及数据记录、跟踪及监控产品温度历史。对于原料而言,冷冻运输尤其具有挑战性,如果使用一次性包装,通常用于储存冷冻药物/产品的一次性袋子可能会因运输和搬运过程中产生的压力而导致破裂和泄漏,从而造成潜在的损失风险。因此,冷链对于生物制药是一个具有挑战性和昂贵的,也是发展强大供应链的潜在障碍。
缓解与冷链相关的挑战和风险的一个策略是将生物药品制成原料粉末。从DS中去除水分可以稳定生物制剂,因此冻干(冷冻干燥)是DP生产中常用的工艺。干燥粉末形式的长期室温稳定性可能有助于商业制造和分销到发展中国家市场,而无需复杂的冷链基础设施。
粉末DS策略提供的另一个重要优势是在产品开发生命周期中灵活选择多种DP选项。比如通过改变复溶重组体积,可以从单个粉末DS批次中制造多个液体DP配方,以实现一系列浓度。或者,可以制造无菌粉末DS,然后将其无菌填充分装到西林瓶、注射器、双腔注射器或其他设备技术中,供患者/护理者通过复溶重组和给药最终使用。这可以使新型粉末DP呈现市场差异化,具有长期、室温储存和患者方便的额外好处。

传统的无菌散装粉末制造技术 VS 喷雾冷冻干燥技术
原料粉末的制造对生物制药行业来说并不新鲜。有很多可用的加工方法,如冷冻干燥和喷雾干燥。这两种传统工艺都具有优势,并存在一些挑战和局限性。
例如,传统的冷冻干燥通常工艺要求分批加工,不会产生均匀、自由流动的粉末。这对于大容量生物制品来说是一个潜在的缺点,因为低加工效率和容器间的变异性会影响产品质量属性。
喷雾干燥是一种行之有效的连续生产方法,用于从液相产生无菌本体粉末。该方法是活性药物成分(API)和其他低分子量(LMW)化合物的理想选择,但并非适用于所有生物分子的平台,尤其不适用于易受热应力和剪切应力影响的生物分子。
喷雾冷冻干燥可看作是一个由两个步骤构成的连续过程,解决了传统的生物技术处理技术的局限性。设备将两个工艺步骤集成到一个完全封闭的单元中,该单元可以在位清洗(CIP)和蒸汽灭菌(SIP),确保工艺的无菌性,同时它使生产的微粒可以自由流动,适用填充到许多容器类型。
工艺和设备概述
第一步:喷雾冷冻
这种操作类似于常规喷雾干燥,因为它适合于大批量制造的连续加工。在此步骤中,使用低剪切频率喷嘴通过受控的气流将液体喷射为大小相同的单个液滴。液滴从冷却腔体中落下,冷却腔体通过液氮使内部空气温度保持在-110°C以下,使液滴冻结成离散的微球。单个微球的直径由喷嘴直径控制,直径范围为250至1000微米。较大的液滴尺寸可控性可以在工艺过程中最小化界面应力。典型的喷雾干燥过程产生较小的液滴尺寸,具有较高的界面表面积,增加在空气-液体界面中出现降解的潜在可能。
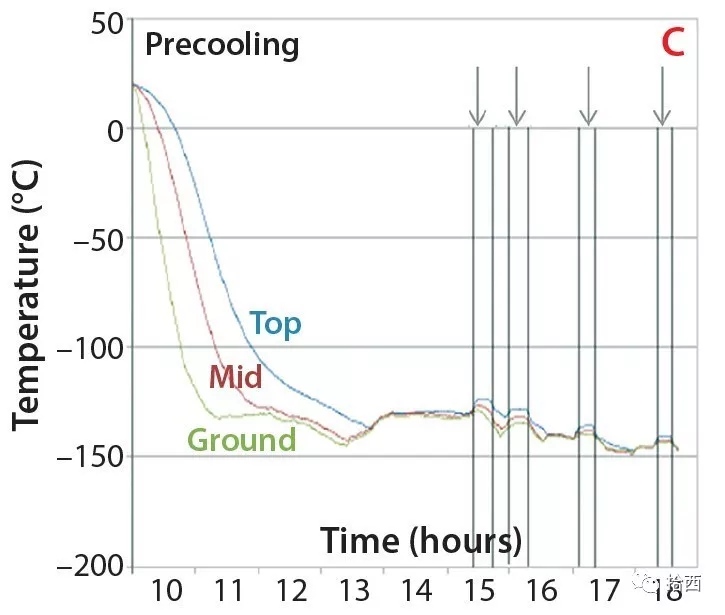
第二步:“动态”冷冻干燥。
在此操作过程中,冻结的球体通过内部输送管投放到温度控制的干燥机中。在那里,它们在真空中被大量冷冻干燥,并持续、温和地混合。干燥完成后,冻干微球被排放到一个中间容器中,该容器可与无菌隔离装置对接,用于粉末填充。
制备单克隆原料粉末MAb DS:
为了评价喷雾冷冻步骤,在50, 100, 150和200 g/L的浓度下制备液体mAb制剂。喷雾冷冻操作使用三个喷嘴,每个喷嘴具有300μm的孔。控制喷嘴频率和进液速度,确保产生离散液滴。
对于上述单克隆抗体配方,干燥设备实现24-30小时的快速干燥,因为该产品在“动态”地持续运动,并且整个颗粒表面可用于传热,冷冻干燥时间明显快于传统冷冻干燥。获得尺寸分布均匀且几乎没有颗粒磨损的散装粉末。对于大多数冻干产品而言,低残留水分对于确保长期产品稳定性至关重要。使用该技术加工的所有单克隆抗体制剂的残留水分水平均小于1%。

粉末特性
生产出的mAb微球粉末的关键性能属性包括粉末自由流动性、可重复和均匀的尺寸分布、快速复溶和长期稳定性。
自由流动的微球粉末:
测试了多个喷雾冻干的mAb批次的流动性。
如果将粉末被分类作为“自由流动”、“易流动”、“凝聚”、“非常易凝聚”或“不流动”。
根据流动性测试过程中产生的结果,喷雾冷冻干燥生产的单克隆抗体粉末批次的特点介于自由流动和容易流动。

可重复的粒径和形状:
通过激光散射分析了多个实验室规模和中试规模的喷雾冻干的mAb粉末批次的微球粒径(图5)。显示狭窄的、可重复的尺寸分布,在10微米以下几乎没有颗粒。
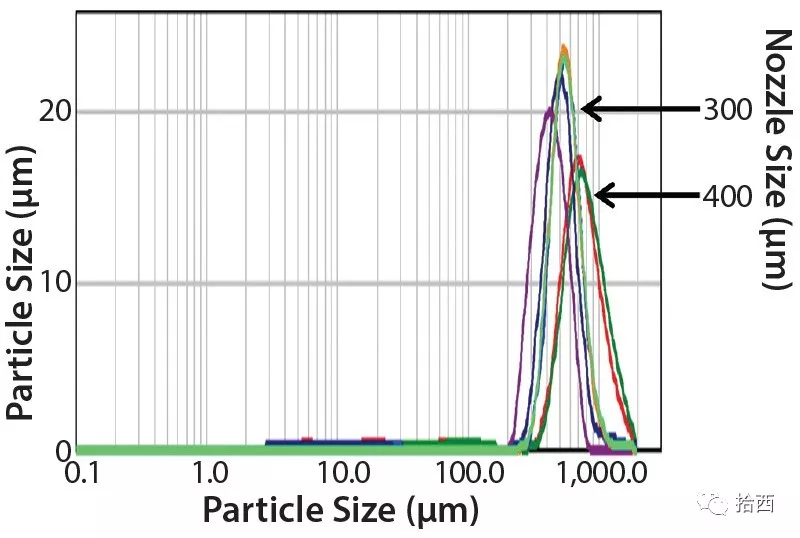
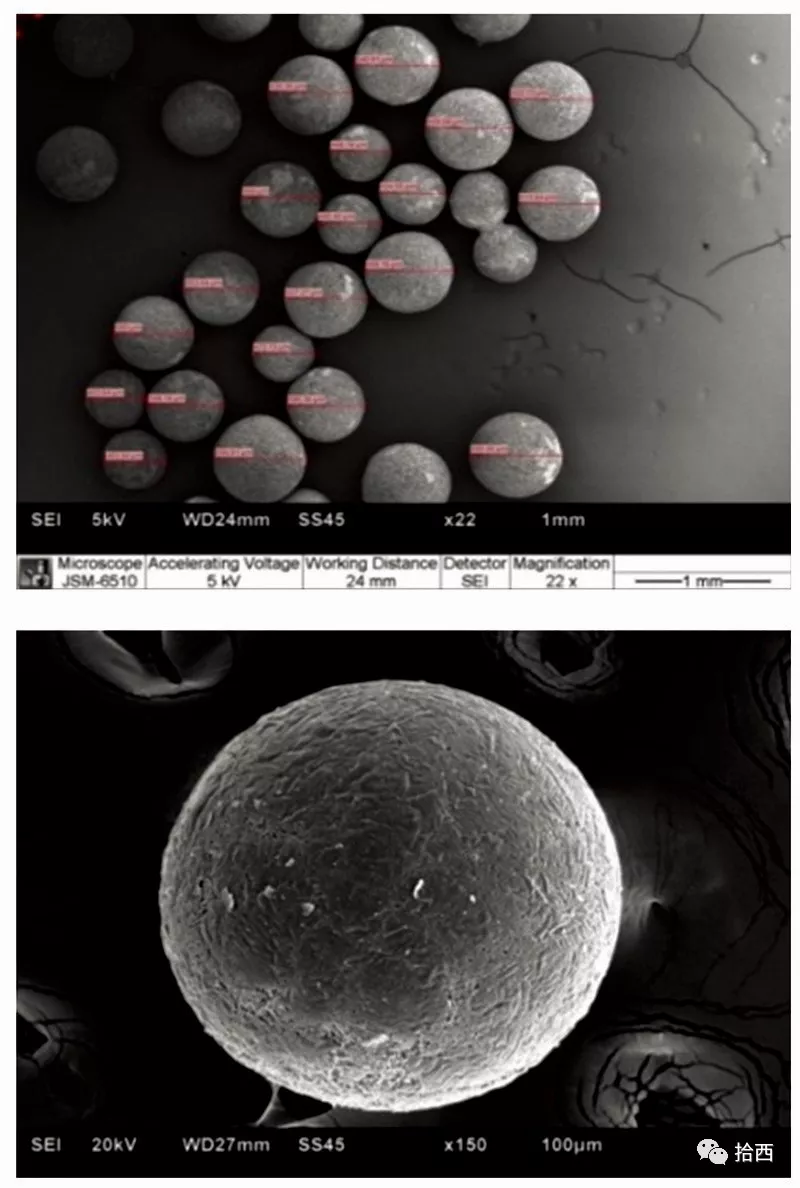
对两种喷嘴尺寸(300微米和400微米)获得的尺寸分布的比较也表明,通过选择所需的喷嘴孔尺寸,可以在工艺过程中控制球体尺寸。此外,扫描电子显微镜(SEM)成像证实了球形颗粒的一致生成。

快速复溶:
通过扫描电镜图像观察微球球体截面,显示这些微球具有高度多孔性。由于mAb微球球面具有较高的表面积和多孔性,因此可以使用不同容量的注射用水(WFI)作为稀释剂来实现其快速湿润和溶解。无论球体大小如何,只要轻轻搅拌两到四分钟,就可以实现完全的复溶。用尺寸排除色谱法(sec)确认复溶后的单克隆抗体聚集水平保持不变,并且不受复溶体积变化的显著影响。

长期室温稳定性:
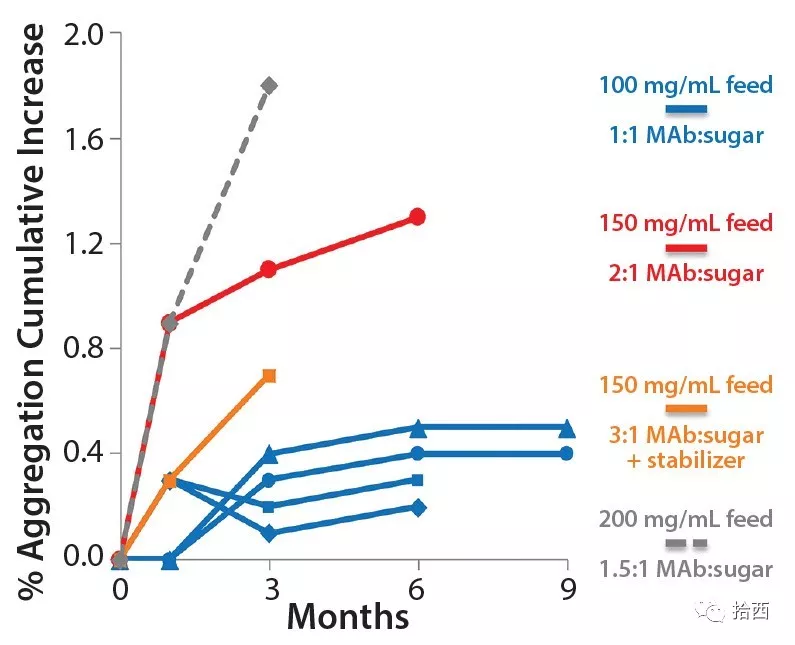
发现使用该技术生产的mAb原料粉末的稳定性与配方高度相关。对于生物制品的常规冷冻干燥,通常需要非晶形糖等保护剂来提供对干燥应力的保护,并提高产品在冷冻干燥状态下的稳定性。因此,mAb与糖组分的比例显著影响mAb粉体的稳定性。确定原料冻干粉末稳定性的另一个重要因素是液态进料溶液中的mAb浓度。总的来说,在含有糖(1:1 w/w mAb:糖)的最低配方中,100 g/l的mAb浓度和表面活性剂在25°C的储存条件下,随着时间的推移,聚集几乎没有增加。现有稳定性数据的预测表明,在喷雾冷冻干燥形式中,这种MAB产品的长期室温储存是可行的。
因此,
在上述初步可行性研究的基础上,采用喷雾冷冻干燥,有望成为生产生物制药DS原料粉末的半/全连续处理方法。然而,这种工艺技术在无菌生产中的全面集成涉及到一些挑战和考虑。从技术、质量和监管角度来看,使用过程模拟(培养基灌装)进行无菌过程验证的方法需要仔细的设计和实施。从验证的角度来看,粉末收集和处理接口设计以及设施物流也需要大量的调查。还应确定合适的原料粉末分/包装技术,以确保在储存和运输过程中保持无菌和其他关键质量属性(CQA)。最后,一些设施安装和工程考虑将与冷却腔体的垂直高度和所需液氮有关的相关因素。
尽管存在这些挑战,喷雾冷冻干燥仍然是一种很有前途的简化供应链物流的策略。这为生物制药的常温原料粉末储存提供了一个新的平台。这项技术的另一个优势是它有潜力实现药品创新,提供灵活的给药途径,可以为室温存储和患者的方便应用提供好处。
文章翻译自:Spray Freeze-Drying Technology: Enabling Flexibility of Supply Chain and Drug-Product Presentation for Biologics,by Deirdre Lowe, Mehak Mehta, Geetha Govindan and Kapil Gupta Friday, December 14, 2018 5:44 pm, Bioprocess international
作者:Shengyi
来源:拾西 公众号
日期:2020年7月20日
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
