在国内色谱分析市场,诸如Waters、Agilent、ThermoFisher和Shimadzu等进口品牌的色谱柱受到广泛认可,而其高昂的价格使实验室运行成本居高不下。企业总是存在降本增效的需要,因此许多分析人员开始寻求性能相当但价格更合理的国产替代品,以达到降低运营成本和提高效率的目的。
无论是进口还是国产品牌,在色谱柱市场上都推出了多种性能和类型各异的产品。以Waters为例,其C18系列涵盖了Symmetry C18、SunFire C18、Nova-Pak C18、XBridge C18、Atlantis T3和Shield RP18等多种型号。这种多样性使得分析人员在选择和替换色谱柱时面临诸多挑战。由于色谱柱的性质信息多属于各厂商的商业机密而很难获取,在等效色谱柱筛选过程中,分析人员通常只能依靠经验进行试错,导致筛选效率低下且成功率不高。不仅于此,即使“试错”的结果“看起来还不错”,也可能难以说服领导、采购,甚至在面对审评和检查时存在合规的风险。因此,如何高效且科学地选择“等效的”色谱柱,成为了摆在广大分析人员面前的一道难题。这不仅需要对色谱柱的各项性能参数有深入的了解,还需要对不同品牌和型号之间的差异有清晰的认识。同时,还需要借助一些科学的筛选方法和工具,以提高筛选效率和成功率,还能给出充分的理论与实验依据。
本文介绍一种名为“疏水差减模型”(Hydrophobic subtraction model)的方法,用于评估色谱柱之间的相似度。通过测试一系列具有不同化学性质的标准品的保留值,并应用模型公式进行多元线性回归分析,可以得到每个色谱柱的特征参数。通过比较不同色谱柱的这些参数,我们可以获得色谱柱相似度数据,为色谱柱等效替代提供参考。
目录[隐藏] |
1. 疏水差减模型简介和研究思路
疏水差减模型(Hydrophobic subtraction model)由分析科学家Synder等于2002提出并建立,并在2002-2005年间进行了完整的验证。验证后的模型采用18溶质法(见表1)按照如下方程进行色谱柱参数的计算:
-
- log α=log (k/kEB)=η’H-σ’S*+β’A+α’B+κ’C(2.8)(1)
-
- C(7.0)=C(2.8)+log(k7.0/k2.8)(2)
其中,k和kEB分别是溶质分子和参考化合物乙苯(EB)的容量因子,k2.8和k7.0分别是小檗碱在pH2.8和pH7.0条件下测得的容量因子。希腊字母η’、σ’、β’、α’、κ’是16种溶质分子的属性,分别代表:
- 疏水作用(η’)
- 空间位阻作用(σ’)
- 接受质子氢键作用(β’)
- 给质子氢键作用(α’)
- 阳离子交换作用(κ’)
其数值在模型建立阶段已经测试得到(表1)。
大写字母H、S*、A、B、C(2.8)、C(7.0)则是我们关心的色谱柱参数,分别代表:
- 疏水作用(H)
- 空间位阻作用(S*)
- 给质子氢键作用(A)
- 接受质子氢键作用(B)
- pH2.8条件下的阳离子交换作用(C(2.8))
- pH7.0条件下的阳离子交换作用(C(7.0))
本文采取的研究思路是,按照该模型,以硫脲(1#)为死时间标记物,计算16种溶质(2-17#)在pH2.8条件下的容量因子,按照方程(1)进行多元线性回归,即可得到色谱柱的H、S*、A、B、C(2.8)这5个参数。再根据小檗碱在pH2.8和pH7.0条件下测得的容量因子,按照方程(2),即可计算得到C(7.0)。
说明:C(7.0)代表在pH7.0条件下的阳离子交换活性,主要由离子化的硅醇基引起,小檗碱是一种季铵盐,在pH7.0时会完全离子化,用小檗碱评估离子交换活性可避免其它弱碱在pH7.0不能完全电离带来的测量误差。
| No. | Solute | 溶质 | η’ | σ’ | β’ | α’ | κ’ |
| 1 | Thiourea | 硫脲 | / | / | / | / | / |
| 2 | Acetophenone | 乙酰苯 | -0.744 | 0.133 | 0.059 | -0.152 | -0.009 |
| 3 | Benzonitrile | 苯甲腈 | -0.703 | 0.317 | 0.003 | 0.080 | -0.030 |
| 4 | Anisole | 苯甲醚 | -0.467 | 0.062 | 0.006 | -0.156 | -0.009 |
| 5 | Toluene | 甲苯 | -0.205 | -0.095 | 0.011 | -0.214 | 0.005 |
| 6 | Ethylbenzene | 乙苯 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 7 | 4-Nitrophenol | 对硝基苯酚 | -0.968 | 0.040 | 0.009 | 0.098 | -0.021 |
| 8 | 5-Phenylpentanol | 5-苯基戊醇 | -0.495 | 0.136 | 0.030 | 0.610 | 0.013 |
| 9 | 5,5-Diphenylhydantoin | 苯妥英 | -0.940 | 0.026 | 0.003 | 0.568 | 0.007 |
| 10 | cis-Chalcone | 顺式查尔酮 | -0.048 | 0.821 | -0.030 | 0.466 | -0.045 |
| 11 | trans-Chalcone | 反式查尔酮 | 0.029 | 0.918 | -0.021 | -0.292 | -0.017 |
| 12 | N,N-Dimethylacetamide | N,N-二甲基乙酰胺 | -1.903 | 0.001 | 0.994 | -0.012 | 0.001 |
| 13 | N,N-Diethylacetamide | N,N-二乙基乙酰胺 | -1.390 | 0.214 | 0.369 | -0.215 | 0.047 |
| 14 | 4-n-Butylbenzoic acid | 4-正丁基苯甲酸 | -0.266 | -0.223 | 0.013 | 0.838 | 0.045 |
| 15 | Mefenamic acid | 甲芬那酸 | 0.049 | 0.333 | -0.049 | 1.123 | -0.008 |
| 16 | Nortriptyline | 去甲替林 | -1.163 | -0.018 | -0.024 | 0.289 | 0.845 |
| 17 | Amitriptyline | 阿米替林 | -1.094 | 0.163 | -0.041 | 0.300 | 0.817 |
| 18 | Berberine | 小檗碱 | / | / | / | / | / |
由于色谱分离结果受色谱柱性质、样品酸碱性、流动相pH等多方面的影响,为从色谱柱的角度表征两个柱子的相似性,该模型建立了色谱柱相似度比较方程如下:
-
- F*s={[12.5(H2-H1)]2+[100(S*2-S*1)]2+[30(A2-A2)]2+[143xB(B2-B1)]2+[83xc(C2-C1)]2}1/2(3)
按照方程(3)计算,当Fs* < 3时,代表两根色谱柱的选择性接近,可实现等效替代。考虑到实际分离场景的复杂性,须考虑以下情况:
- 当流动相pH为2.8或7.0时,可直接将C(2.8)或C(7.0)代入计算;
- 当流动相pH < 2.8时,可假定C = C(2.8);
- 当流动相pH > 7.0时,可假定C = C(7.0);
- 当流动相2.8 < pH < 7.0时,则需按照如下方程计算该pH值下的C值:
-
- C=C(2.8)+([pH]-2.8)/(7.0-2.8)·(C(7.0)-C(2.8))
- 修正系数xB的值
- 若样品中不包含羧酸,xB = 0;
- 若样品中包含羧酸,xB = 1;
- 修正系数xC的值
- 若样品中既不含强碱,也不含弱碱,xC = 0;
- 若样品中包含强碱(pKa > 9)时:
-
- 当流动相pH < 6时,xC = 1;
-
- 当流动相6 < pH < 10时,xC = 0.1;
-
- 当流动相pH > 10时,xC = 0;
- 当样品中包含弱碱时:
-
- 当流动相pH < 5时,xC =0.1;
-
- 当流动相pH > 5时,xC = 0;
- 特殊地,在要求不严格的情况下,为简化xC取值的复杂性,可按照如下规则来取值:
-
- 当样品中不包含碱,xC = 0;
-
- 当样品中包含碱,xC = 1。
2. 具体实验方法
上一节简单介绍了疏水差减模型的概念,以及如何根据疏水差减模型中的色谱柱参数值进行不同色谱柱间的相似度参数计算思路,本节将着重介绍一下疏水差减模型的实验方法。
2.1 样品
实验所需的18种溶质分子,按照其保留行为的差异,分为如下7组(每种溶质的浓度均为50 μg/mL):
- #1:硫脲、阿米替林、4-正丁基苯甲酸;
- #1a:N,N-二乙基乙酰胺、5-苯基戊醇、乙苯;
- #2:N,N-二甲基乙酰胺、苯妥英、甲苯
- #2a:去甲替林、乙酰苯、甲芬那酸
- #3:对硝基苯酚、苯甲醚
- #3a:苯甲腈、顺式查尔酮、反式查尔酮
- #4:小檗碱
2.2 色谱方法
色谱柱规格:4.6 × 150 mm,5 μm
流动相:① ACN/60mM KH2PO4(用60mM H3PO4调节pH2.8)(50/50, v/v)
-
- ②ACN/60mM K2HPO4(用60mM H3PO4调节pH7.0)(50/50, v/v)
流速:2 mL/min
温度:35 ℃
检测波长:UV@205 nm
进样量:10 μL
注意:所有7组样品均需进样pH2.8的的条件,其中,#1 ~ #3a样品的测试结果可直接应用通过(1)进行多元线性回归,得到色谱柱的H、S*、A、B、C(2.8)的值。#4样品还需进样pH7.0的条件,并通过方程(2)计算色谱柱的C(7.0)的值。
2.3 实例
实例选择了Alphasil VC-C18(4.6×150mm,5μm,来自国内的华谱科仪(北京)科技有限公司)和Ascentis C18(4.6×150mm,5μm,Supelco)这两款色谱柱,按照如上方法进行测试,得到的数据如表2所示:
| 样品组 | 样品名称 | Alphasil VC-C18 | Ascentis C18 | ||||
| 保留时间/min | k | log α | 保留时间/min | k | log α | ||
| 样品#1 (pH=2.8) | 硫脲 | 0.627 | / | / | 0.650 | / | / |
| 阿米替林 | 1.04 | 0.659 | -1.293 | 1.097 | 0.688 | -1.229 | |
| 4-正丁基苯甲酸 | 4.375 | 5.978 | -0.336 | 4.278 | 5.582 | -0.320 | |
| 样品#1a (pH=2.8) | N,N-二乙基乙酰胺 | 0.871 | 0.389 | -1.522 | 0.886 | 0.363 | -1.506 |
| 5-苯基戊醇 | 2.83 | 3.514 | -0.566 | 2.745 | 3.223 | -0.558 | |
| 乙苯 | 8.745 | 12.947 | 0.000 | 8.222 | 11.649 | 0.000 | |
| 样品#2 (pH=2.8) | N,N-二甲基乙酰胺 | 0.695 | 0.108 | -2.077 | 0.717 | 0.103 | -2.053 |
| 苯妥英 | 1.333 | 1.126 | -1.061 | 1.366 | 1.102 | -1.024 | |
| 甲苯 | 5.617 | 7.959 | -0.211 | 5.340 | 7.215 | -0.208 | |
| 样品#2a (pH=2.8) | 去甲替林 | 0.973 | 0.552 | -1.370 | 1.032 | 0.588 | -1.297 |
| 乙酰苯 | 1.883 | 2.003 | -0.810 | 1.842 | 1.834 | -0.803 | |
| 甲芬那酸 | 8.488 | 12.537 | -0.014 | 8.080 | 11.431 | -0.008 | |
| 样品#3 (pH=2.8) | 对硝基苯酚 | 1.301 | 1.075 | -1.081 | 1.321 | 1.032 | -1.052 |
| 苯甲醚 | 3.168 | 4.053 | -0.504 | 3.050 | 3.692 | -0.499 | |
| 样品#3a (pH=2.8) | 苯甲腈 | 1.973 | 2.147 | -0.780 | 1.934 | 1.975 | -0.771 |
| 顺式查尔酮 | 7.126 | 10.365 | -0.097 | 6.624 | 9.191 | -0.103 | |
| 反式查尔酮 | 8.588 | 12.697 | -0.008 | 7.869 | 11.106 | -0.021 | |
| 样品#4 (pH=2.8) | 小檗碱 | 0.857 | 0.367 | -1.548 | 0.883 | 0.358 | -1.512 |
| 样品#4 (pH=7.0) | 小檗碱 | 0.89 | 0.419 | 0.058 | 0.877 | 0.349 | -0.011 |
按照方程(1)进行多元线性回归,得到两根色谱柱的H、S*、A、B、C(2.8)的数值,按照方程(2)可计算得到两根色谱柱的C(7.0)的数值,见表3。从表3中的数据可知,标准误差在可接受范围,测试结果准确。
| 色谱柱 | Alphasil VC-C18 | Ascentis C18 | ||
| 固定相参数 | 标准误差 | 固定相参数 | 标准误差 | |
| H | 1.098 | 0.005 | 1.074 | 0.004 |
| -S* | 0.043 | 0.007 | 0.056 | 0.006 |
| A | 0.014 | 0.014 | -0.010 | 0.012 |
| B | -0.045 | 0.005 | -0.036 | 0.004 |
| C(2.8) | -0.091 | 0.010 | -0.044 | 0.008 |
| C(7.0) | -0.033 | / | -0.055 | / |
根据方程(3),xC按照样品中含碱为1,不含碱为0的方式来取值,计算在样品中无酸无碱、有酸无碱、无酸有碱(pH2.8)、无酸有碱(pH7.0)、有酸有碱(pH2.8)、有酸有碱(pH7.0)共6种情况下两根色谱柱的相似度,如表4所示。
| 样品性质/流动相pH | Alphasil VC-C18与Ascentis C18相似度 |
| Fs无酸无碱 | 1.52 |
| Fs有酸无碱 | 2.03 |
| Fs无酸有碱(pH=2.8) | 4.18 |
| Fs无酸有碱(pH=7.0) | 2.38 |
| Fs有酸有碱(pH=2.8) | 4.93 |
| Fs有酸有碱(pH=7.0) | 2.73 |
从表4中可见,国产的Alphasil VC-C18与Ascentis C18的相似度除在pH2.8条件下且样品中有碱性化合物时(相似度达到4.18、4.93)大于3之外,其余各种场景的相似度参数均在3以下,即可认为两根色谱柱选择性在无酸无碱、有酸无碱、无酸有碱(pH7.0)、有酸有碱(pH7.0)的条件下基本一致。
3. 结果验证
为验证上述结果,本文选取了两组样品进行相似度比较的验证。样品选择充分考虑了两根色谱柱在不同样品性质/流动相pH的相似度因子,避开相似度因子大于3的场景,验证其等效替代性。
第一组样品为11个酚酸类化合物,对应Fs(有酸无碱)=2.03的情况,溶质分子包括苯酚、4-硝基苯酚、2-氯苯酚、2_硝基苯酚、2,4-二甲基苯酚、2,4-二硝基苯酚、4-氯-3-甲基苯酚、2,4-二氯苯酚、2-甲基-4,6-二氯苯酚、2,4,6-三氯酚、五氯酚。
色谱方法为:
色谱柱:①Alphasil VC-C18;4.6× 150 mm, 5 μm;
-
- ②Ascentis® C18;4.6× 150 mm, 5 μm;
流动相:A_0.1%磷酸-水溶液;B_乙腈
流速:1.0 ml/min
进样量:5 μL
温度:40℃
检测器:UV@214 nm
梯度:
| Time(min) | %A | %B |
| 0 | 75 | 25 |
| 9 | 60 | 40 |
| 14 | 25 | 75 |
| 16 | 0 | 100 |
| 20 | 0 | 100 |
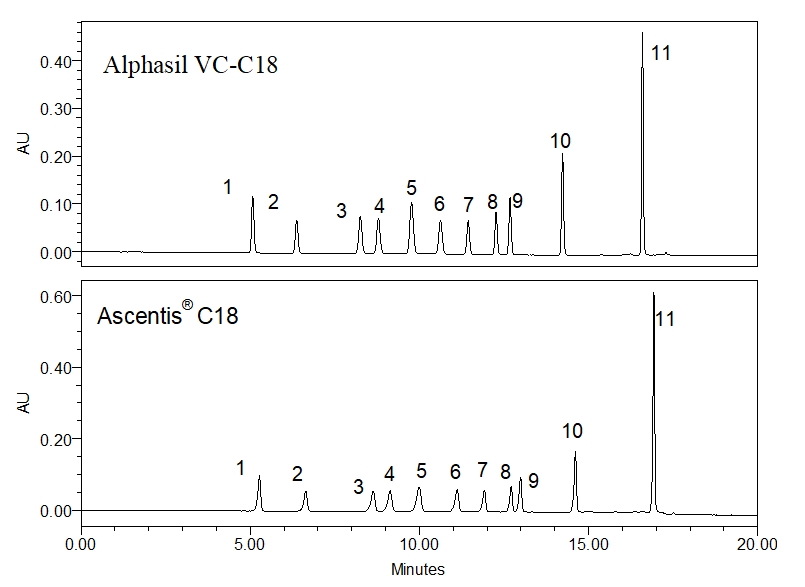
11种酚酸类化合物在两根色谱柱上的色谱图为:
(峰1_苯酚;峰2_4-硝基苯酚;峰3_2-氯苯酚;峰4-2_硝基苯酚;峰5_2,4-二甲基苯酚;峰6_2,4-二硝基苯酚;峰7_ 4-氯-3-甲基苯酚;峰8_2,4-二氯苯酚;峰9_2-甲基-4,6-二氯苯酚;峰10_2,4,6-三氯酚;峰11_五氯酚)
从分离结果来看,两根色谱柱对11种酚酸类化合物的保留时间基本一致,选择性也基本一致,证明在该方法下,两个色谱柱可以实现等效替代。
第二组样品为6种邻苯二甲酸酯类化合物,对应Fs(无酸无碱)=1.52的情况,溶质分子包括、邻苯二甲酸二甲酯、邻苯二甲酸二乙酯、邻苯二甲酸二正丁酯、邻苯二甲酸丁苄酯、邻苯二甲酸二 (2-乙基己)酯、邻苯二甲酸二正辛酯。
色谱方法为:
色谱柱:①Alphasil VC-C18;4.6× 150 mm, 5 μm;
-
- ②Ascentis® C18;4.6× 150 mm, 5 μm;
流动相:A_水;B_乙腈
流速:1.0 ml/min
进样量:10 μL
温度:30℃
检测器:UV@280 nm
梯度:
| Time(min) | %A | %B |
| 0 | 20 | 80 |
| 2 | 20 | 80 |
| 4 | 0 | 100 |
| 15 | 0 | 100 |
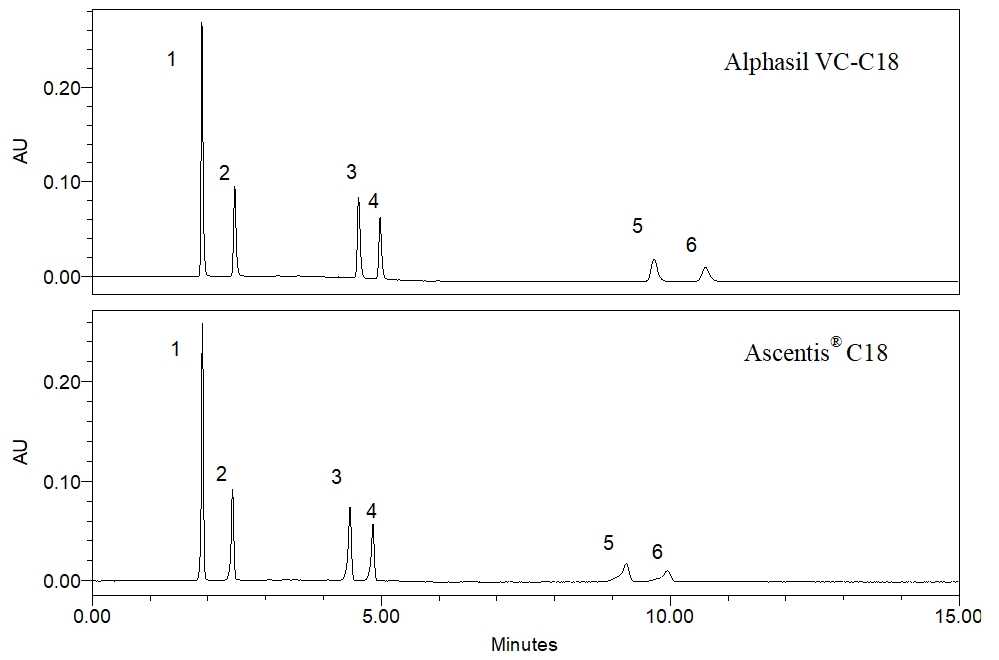
6种邻苯二甲酸酯类化合物在两根色谱柱上的色谱图为:
(峰1_邻苯二甲酸二甲酯;峰2_邻苯二甲酸二乙酯;峰3_邻苯二甲酸二正丁酯;峰4_邻苯二甲酸丁苄酯;峰5_邻苯二甲酸二 (2-乙基己)酯;峰6_邻苯二甲酸二正辛酯)
从分离结果来看,两根色谱柱对6种邻苯二甲酸酯类化合物的保留时间基本一致,选择性也基本一致,证明在该方法下,两个色谱柱可以实现等效替代。
4. 结论
本文介绍了一种评估不同色谱柱之间相似度的方法——疏水差减模型,包括其原理、实验方法和相似度计算方法等。通过一个案例详细展示了如何应用该模型比较两根色谱柱在不同样品性质和流动相pH条件下的相似度,并通过实验验证了该模型的可靠性。结果表明,疏水差减模型能有效评估色谱柱之间的相似性,为色谱柱等效替代提供科学指导。分析人员可以结合理论与实验,确证市场上的优质国产色谱柱的等效性,从技术与合规两个角度论证国产替代的合理性和风险可控,同时帮助实验室降低运营成本并提高效率。
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因: