《药品上市后变更管理办法(试行)》规定原料药变更实施前,原料药登记人应当将有关情况及时通知相关制剂持有人,制剂持有人接到上述通知后应当及时就相应变更对影响药品制剂质量的风险情况进行评估或研究,根据有关规定提出补充申请、备案或报告。但涉及到具体的变更,制剂持有人应该怎么做,是很多制剂企业都会遇到的问题。
2023年9月1日,CDE发布了“关于公开征求《〈已上市化学药品药学变更研究技术指导原则(试行)〉原料药变更的问答(征求意见稿)》意见的通知”。对变更指导原则中原料药变更时相关制剂持有人应进行哪些研究工作进行详细的解读。征求意见时限为自发布之日起1个月。
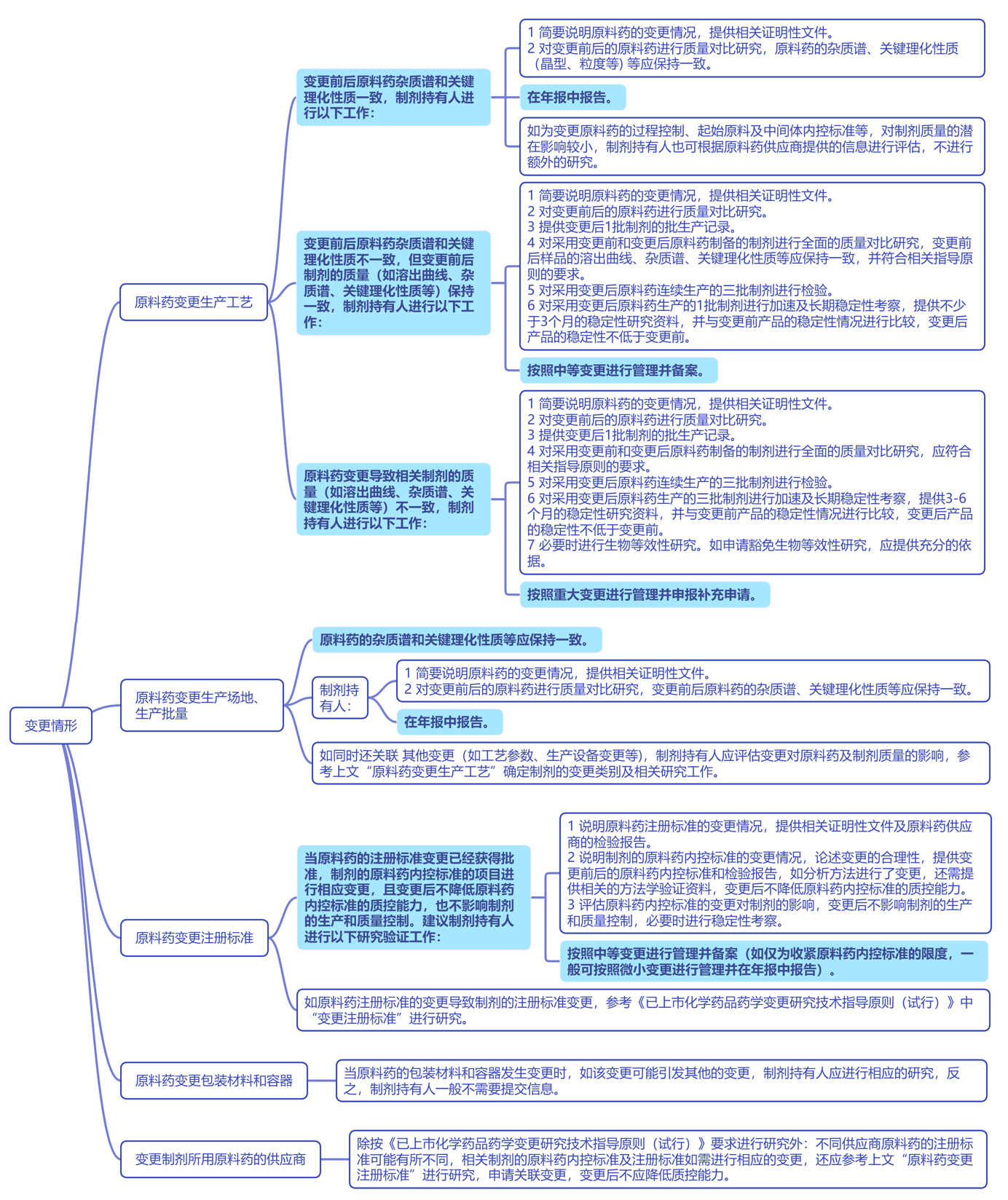
以下为要点整理,与大家共同学习探讨:



举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:
评论
匿名
提交
取消
匿名
{{item_parent.created_at}}
置顶
批准
驳回
编辑
等待审核
已驳回
回复
{{item_parent.show_reply_list ? '收起回复' : '查看回复'}}({{item_parent.children.length}})
编辑
提交
取消
写回复
匿名
提交
取消
{{item_children.from_user}} 回复 {{item_children.to_user}}
{{item_children.created_at}}
批准
驳回
编辑
等待审核
已驳回
回复
编辑
提交
取消
写回复
匿名
提交
取消
举报
提交
取消
为帮助审核人员更快处理,请填写举报原因:

我对这个也有个疑问:
1、API变更里面的微小变更和中等变更都要求杂质谱和关键理化一致,如果不一致就是重大变更了。而这里又说如果变更前后杂质谱和关键理化不一致,但对制剂没有影响,可以按中等变更?
是不是说后续只要API变更不影响制剂,都可以按中等变更操作?
我明白你说的意思了,严格按照这俩指导原则的话,是这样的:
对于原料药企业:原料药变更,按照21年的变更指导原则试行,微小和中等变更都要求杂质谱和关键理化一致,如果不一致原料药企业就需要按照重大变更报。
对于制剂企业:原料药变更,杂质谱和关键理化不一致,但是对制剂没有影响,按照现在这个征求意见稿,制剂企业可以按照中等变更报。
也就是同一个变更,原料药企业按重大报、制剂企业按中等报。但是对于制剂企业,其实仍需要等原料药企业重大变更批的时间。
理解了 谢谢~~~~~~~~~